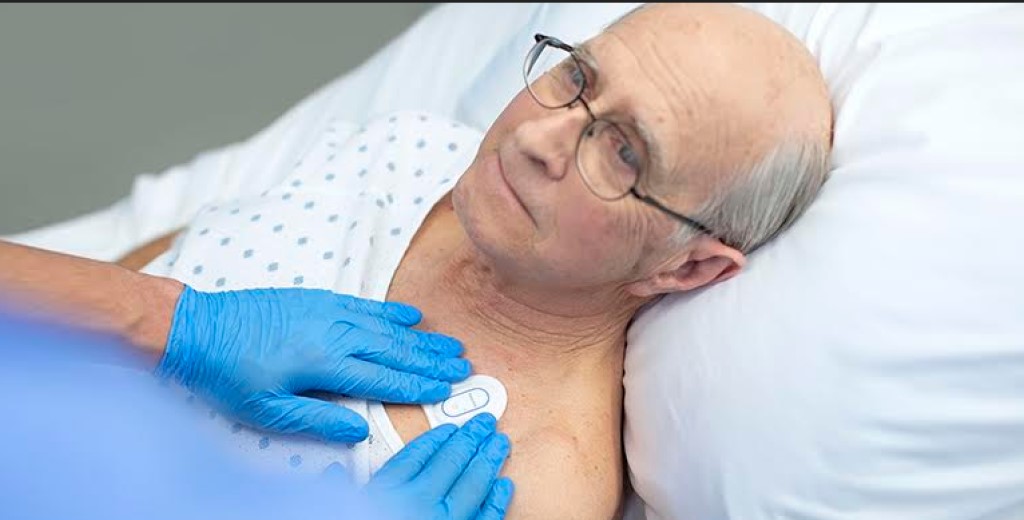
A Royal Philips, dedicada ao desenvolvimento de tecnologias da saúde, recebeu a autorização 510 (k) da Food and Drug Administration (FDA) para o seu biossensor wearable (Philips Biosensor BX100) que permite ajudar a gerir pacientes confirmados e suspeitos com COVID-19 no hospital.
A nova geração de biossensor wearable sem fios reforça a vigilância clínica na detecção do agravamento de pacientes, ajudando os médicos a detectar riscos, de forma a poderem intervir mais cedo e ajudar a melhorar o cuidado dos pacientes. Esta ferramenta já recebeu o selo CE e a primeira instalação está actualmente a ser utilizada no Hospital OLVG, na Holanda, para ajudar a gerir a triagem e a vigilância clínica de pacientes com COVID-19.
O Biossensor Philips BX100 foi projectado para trazer uma nova abordagem à medição de sinais vitais, apoiando a vigilância de pacientes de menor gravidade, passando de unidades de cuidados intensivos para áreas de cuidados gerais de menor vigilância num hospital.
O biossensor descartável é um adesivo de cinco dias para utilização única que pode ser integrado numa plataforma para monitorizar vários pacientes, em vários quartos.
Criado para incorporar os fluxos de trabalho clínicos existentes para visualização e notificações em dispositivos móveis, o dispositivo não requer limpeza ou carregamento.
O biossensor wearable sem fios, para utilização por parte de profissionais de saúde em pacientes com 18 anos de idade ou mais, adere discretamente ao peito para recolher, armazenar, medir e transmitir a frequência respiratória e a frequência cardíaca a cada minuto – os dois principais elementos de previsão de agravamento – bem como parâmetros contextuais, como postura, nível de actividade e deambulação.